- su nombre completo y el grado al cual pertenece
- el número de la actividad
la fecha de entrega de la presente actividad es el día 19 de junio.
Estaré enviando a ustedes vía whatsapp el link de la clase en línea para explicar las dudas acerca de esta temática, la plataforma sugerida para dicha clase es zoom.
la clase en línea esta programada para el día miércoles 10 y 11 de junio a las 3 p.m.
Carol Ramirez le está invitando a una reunión de Zoom programada.
Tema: CLASE GRADO UNDÉCIMO FÍSICA 10 DE JUNIO
Hora: 10 jun 2020 03:00 PM Bogotá
Unirse a la reunión Zoom
https://us04web.zoom.us/j/74104477911?pwd=OTRqU21iblFvbXZLcjd2VC9kZEUvQT09
ID de reunión: 741 0447 7911
Contraseña: 9vSFeM
Por favor al conectarse escribir nombre completo y grado al cual pertenece.
INTRODUCCIÓN AL MOVIMIENTO ONDULATORIO
CONCEPTO DE ONDA:
Una onda es aquella perturbación en los medios elásticos o deformables. Es transportadora de energía; pero es incapaz de desplazar una masa en forma continua. Toda onda al propagarse da lugar a vibraciones.
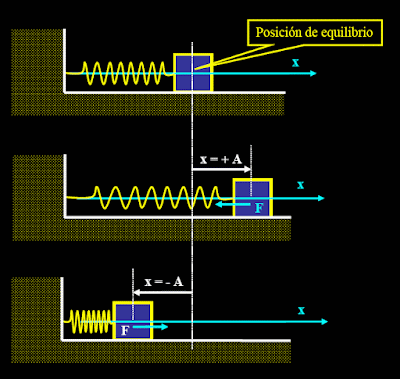
El movimiento ondulatorio es un proceso por el que se propaga energía de un lugar a otro sin transferencia de materia, mediante ondas mecánicas o electromagnéticas. En cualquier punto de la trayectoria de propagación se produce un desplazamiento periódico, u oscilación, alrededor de una posición de equilibrio. Puede ser una oscilación de moléculas de aire, como en el caso del sonido que viaja por la atmósfera, de moléculas de agua (como en las olas que se forman en la superficie del mar) o de porciones de una cuerda o un resorte. En todos estos casos, las partículas oscilan en torno a su posición de equilibrio y sólo la energía avanza de forma continua. Estas ondas se denominan mecánicas porque la energía se transmite a través de un medio material, sin ningún movimiento global del propio medio. Las únicas ondas que no requieren un medio material para su propagación son las ondas electromagnéticas; en ese caso las oscilaciones corresponden a variaciones en la intensidad de campos magnéticos y eléctricos.
CLASIFICACION DE LAS ONDAS
Se pueden utilizar varios criterios diferentes para clasificar las ondas. Una primera clasificación puede hacerse atendiendo al tipo de medio en el que pueden propagarse:
- Ondas electromagnéticas (OEM): se transmiten en ciertos materiales y también en el vacío (la luz se propaga en el aire, agua, vidrio, etc. pero también se propaga en el vacío, como ocurre con la luz de las estrellas).
- Ondas mecánicas: solo se transmiten en los medios materiales estas las trataremos en esta unidad, dejando el estudio de las ondas electromagnéticas para otra unidad posterior.
Otro criterio para clasificar las ondas, es atender a la relación entre las direcciones
de la perturbación producida y la de propagación de la onda:
- Onda transversal: es aquella en la que la dirección de propagación es perpendicular a la dirección de la perturbación. Un ejemplo puede ser la propagación horizontal de una onda en una cuerda a la que se agita verticalmente. Las ondas electromagnéticas también son transversales.
- Onda longitudinal: es aquella en la que la dirección de propagación tiene la misma dirección que la de la perturbación producida. Ejemplos pueden ser el sonido o el de un muelle que se comprime longitudinalmente.
Las ondas longitudinales pueden propagarse en medios sólidos, líquidos o gaseosos. Las ondas transversales solo pueden hacerlo en medios sólidos, ya que es necesario
que existan fuerzas de suficiente intensidad entre partículas vecinas para que la propagación transversal pueda darse.
Una de las pruebas de que el interior de la Tierra debe estar en estado líquido es
que a su través solo se propagan ondas longitudinales y no transversales. Como sabes,
hay ondas sísmicas de dos clases, unas llamadas ondas P que son longitudinales y
otras denominadas ondas S que son transversales. Cuando ocurre un terremoto en un
lugar de la Tierra, se detectan ondas longitudinales en las antípodas de ese lugar pero
nunca ondas transversales. Estas no pueden atravesar el centro de la Tierra, por lo que
se llega a la conclusión de que el interior de la Tierra no debe estar sólido.
Las ondas se pueden clasificar también como ondas unidimensionales, bidimensionales y tridimensionales, según el numero de dimensiones en que propague la energía. las ondas que se mueven en una cuerda horizontal o en el resorte vertical son unidimensionales. las olas u ondas en el agua son bidimensionales. las ondas sonoras y las ondas luminosas son tridimensionales.
EJEMPLOS RESUELTOS
Referencias:
Algunos pantallazos tomados del libro: DUEÑAS, J. M. (2002). FÍSICA. Lima: DISTRIBUCIÓN.