Estaré enviando a ustedes vía whatsapp el link de la clase en línea para explicar las dudas acerca de esta temática, la plataforma sugerida para dicha clase es zoom.
la clase en línea esta programada para el día miércoles 27 de mayo a las 3 p.m.
les envío un fuerte abrazo, espero que todos se encuentren bien. Los extraño mucho.🙅🙅🙅
TRABAJO Y ENERGÍA
segunda parte
segunda parte
EL TRABAJO
Trabajo (física): Es el producto de una fuerza aplicada sobre un cuerpo y del desplazamiento del cuerpo en la dirección de esta fuerza. Mientras se realiza trabajo sobre el cuerpo, se produce una transferencia de energía al mismo, por lo que puede decirse que el trabajo es energía en movimiento.
El trabajo es una magnitud física escalar que se representa con la letra W (del inglés Work) y se expresa en unidades de energía, esto es en julios o joules (J) en el Sistema Internacional de Unidades.
Por lo tanto. El trabajo es igual al producto de la fuerza por la distancia y por el coseno del ángulo que existe entre la dirección de la fuerza y la dirección que recorre el punto o el objeto que se mueve.
Concepto de trabajo
El Trabajo es una de las formas de transferencia (cuando dos cuerpos intercambian energía, lo hacen, o bien de forma mecánica, mediante la realización de un trabajo, o bien de forma térmica, mediante el calor) de energía entre los cuerpos. Para realizar un trabajo es preciso ejercer una fuerza sobre un cuerpo y que éste se desplace.
El trabajo, W, depende del valor de la fuerza, F, aplicada sobre el cuerpo, del desplazamiento, ∆x y del coseno del ángulo α que forman la fuerza y el desplazamiento.
W = F . cos α . ∆x
El trabajo, se mide en julios (J) en el SI, la fuerza en newtons (N) y el desplazamiento en metros (m).
El trabajo de la fuerza de rozamiento
La fuerza de rozamiento es una fuerza que se opone siempre al movimiento. Surge al tratar de desplazar un objeto que se encuentra apoyado sobre otro. Por tanto, siempre formará un ángulo de 180º con el desplazamiento.
El trabajo de la fuerza de rozamiento siempre es negativo. Por eso el rozamiento hace que el cuerpo "gaste" energía cuando se desplaza.
EJEMPLOS:
EJEMPLOS:
TALLER
1. Una grúa sube en forma vertical un bloque hasta una altura de 6 m, a velocidad constante y en un tiempo de 12 s. La potencia disipada para realizar ese trabajo es de 2000 W.
¿Cuál es el peso del bloque?
1. Una grúa sube en forma vertical un bloque hasta una altura de 6 m, a velocidad constante y en un tiempo de 12 s. La potencia disipada para realizar ese trabajo es de 2000 W.
¿Cuál es el peso del bloque?
2. Una bomba sube 1 m3 de agua a una altura de 35 m en 15 minutos.
¿Cuál es el trabajo realizado por la bomba?Datos: Peso específico del agua: 9800 N/m3.
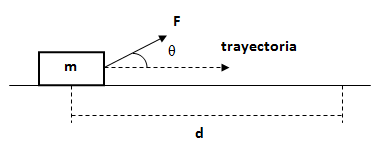
3. Calcular el trabajo que realiza la fuerza F y la fuerza de rozamiento FR sobre la distancia d.
Datos m = 50 kg, F = 250 N, θ = 40°, d = 12 m, μd = 0,15.
referencias: