Hola queridos estudiantes, a continuación les dejo la temática acerca de BALANCEO DE ECUACIONES QUÍMICAS REDOX con ejemplos resueltos, Al final de esta entrada encontraran una actividad para realizar, la cual deberán enviar por correo electrónico, tomando fotografías de su trabajo para adjuntar como archivo, por favor poner en el asunto del correo su nombre completo y el grado al cual pertenece, el correo para recibir sus trabajos es profecarito2017@gmail.com la fecha de entrega de la presente actividad es el día 1 de junio.
Estaré enviando a ustedes vía whatsapp el link de la clase en línea para explicar las dudas acerca de esta temática, la plataforma sugerida para dicha clase es zoom. la clase en línea esta programada para el día MARTES 26 y jueves 28 de mayo.
les envío un fuerte abrazo, espero que todos se encuentren bien. 🏆🎓🎓🎓🎓🎓
BALANCEO DE ECUACIONES QUÍMICAS
OXIDACIÓN-REDUCCIÓN
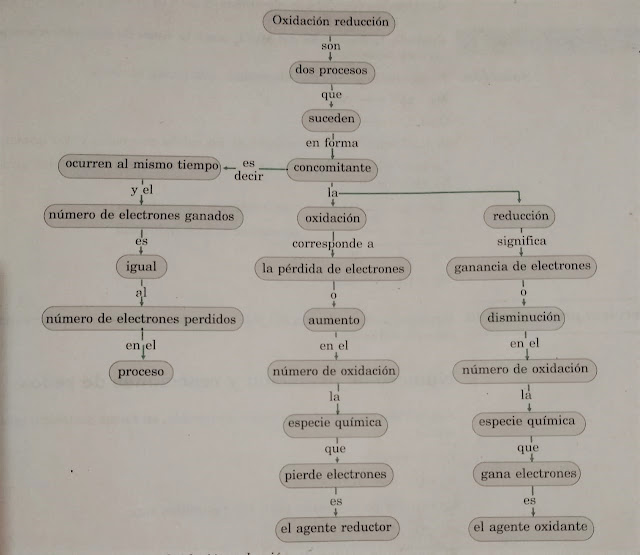
Las reacciones de oxidación-reducción son reacciones que envuelven transferencia de electrones de una especie a otra la definición mas amplia de una reacción de oxidación-reducción se basa en el concepto de un número de oxidación. estos números permiten llevar una contabilidad de los electrones en una reacción.
Las reacciones de oxido-reducción son llamadas reacciones redox, estas deben cumplir con la ley de la conservación de la materia (masa) y la energía (carga) por lo tanto, necesitan balancearse. algunas reacciones son sencillas y se balancean por tanteo y otras un poco mas complejas se deben balancear por el método redox.
Para balancear por el método de oxidación-reducción (redox) se deben tener claros los conceptos acerca de como asignar los estados de oxidación. a continuación les dejo las leyes básicas para asignar estados de oxidación.
ASIGNACIÓN DE ESTADOS DE OXIDACIÓN:
(Tener a mano la tabla periódica)
NUMERO DE OXIDACIÓN Y REACCIONES REDOX
A partir del número de oxidación, es posible, en forma sintética, estudiar las reacciones redox.
estas reacciones envuelven la transferencia de electrones.
Dentro de una reacción, el elemento cuyo estado de oxidación aumenta, se dice que se ha oxidado o que es el elemento que se oxida y el elemento cuyo estado de oxidación disminuye, se dice que se ha reducido o que es el elemento que se reduce.
Dentro de una reacción, el elemento cuyo estado de oxidación aumenta, se dice que se ha oxidado o que es el elemento que se oxida y el elemento cuyo estado de oxidación disminuye, se dice que se ha reducido o que es el elemento que se reduce.
PASOS PARA BALANCEAR POR EL NÚMERO DE OXIDACIÓN
Chequear los números de oxidación de los reactivos y Productos
Supóngase la siguiente ecuación
química:
Cu(s) + AgNO3(ac)
→ Cu(NO3)2 + Ag(s)
Esta corresponde a una reacción redox,
en la que ocurre un cambio en los números de oxidación de los reactivos:
Cu0(s) +
Ag+NO3(ac) →
Cu2+(NO3)2 + Ag(s)0
Identificar las especies oxidante y reductora
La especie oxidante gana electrones
oxidando a la especie reductora. Por lo tanto, su número de oxidación
disminuye: se torna menos positivo. Mientras, el número de oxidación de la
especie reductora aumenta, ya que pierde electrones: se torna más positivo.
Así, en la reacción anterior el cobre
se oxida, ya que pasa de Cu0 a Cu2+; y la plata se
reduce, pues pasa de Ag+ a Ag0. El cobre es la
especie reductora, y la plata la especie oxidante.
Escribir las semirreacciones y balancear átomos y cargas
Identificando qué especies ganan o
pierden electrones, se escriben las semirreacciones redox tanto para la
reacción de reducción como para la de oxidación:
Cu0 → Cu2+
Ag+ → Ag0
El cobre pierde dos electrones,
mientras que la plata gana uno. Colocamos los electrones en ambas
semirreacciones:
Cu0 - 2e– → Cu2+
Ag+1 +1
e– → Ag0
Nótese que las cargas permanecen
balanceadas en ambas semirreacciones; pero si se sumaran, se violaría la ley de
la conservación de la materia: el número de
electrones debe ser igual en las dos semirreacciones. Por lo tanto, la segunda
ecuación se multiplica por 2 y se procede a sumar las dos ecuaciones:
1 x (Cu0 -
2e–→ Cu2+ )
2
x (Ag+ + 1e– → Ag0)
Cu0 +
2Ag+ - 2e– + 2e– → Cu2+ + 2Ag0
Los electrones se cancelan pues al
sumarlos da cero:
Cu0 +
2Ag+ → Cu2+ + 2Ag0
Esta es la ecuación iónica global.
Sustituir coeficientes de la ecuación iónica en la ecuación general
Por último, los coeficientes
estequiométricos de la ecuación anterior se trasladan a la primera ecuación:
Cu(s) + 2AgNO3(ac)
→ Cu(NO3)2 + 2Ag(s)
Nótese que el 2 se posicionó con el
AgNO3 porque en esta sal la plata está como Ag+, y
lo mismo sucede con el Cu(NO3)2. Si esta ecuación no está
balanceada al final, se procede a realizar el tanteo.
La ecuación propuesta en los pasos
anteriores pudo haberse balanceado directamente por tanteo. Sin embargo, hay
reacciones redox que necesitan de un medio ácido (H+) o básico (OH–)
para tener lugar. Cuando esto sucede, no se puede balancear asumiendo que el
medio es neutro; tal como acaba de mostrarse (no se adicionó ni H+ y
tampoco OH–).
Por otro lado, conviene saber que en
las semirreacciones se escriben los átomos, iones o compuestos (óxidos en su
mayoría) en los que ocurren los cambios en los números de oxidación. Esto se
resaltará en el apartado de los ejercicios.
ACTIVIDAD
1.En las siguientes semirreacciones, diga cuales son de oxidación y cuales son de reducción:
2. Para las siguientes ecuaciones escriba las semirreacciones de oxidación y reducción, y diga cual es el agente oxidante y cual el agente reductor:
3. Balancee las siguientes ecuaciones, por el número de oxidación:
Referencias









No hay comentarios.:
Publicar un comentario