Hola queridos estudiantes, a continuación les dejo la temática EJERCICIOS RESUELTOS PRINCIPIO DE PASCAL , Al final de esta entrada encontraran una actividad para realizar, la cual deberán enviar por correo electrónico, tomando fotografías de su trabajo para adjuntar como archivo, por favor poner en el asunto del correo su nombre completo, el número de la actividad y el grado al cual pertenece, el correo para recibir sus trabajos del segundo periodo académico es profecarito2017periodo2@gmail.com la fecha de entrega de la presente actividad es el día 7 de septiembre.
Carol Ramírez le está invitando a una reunión de Zoom programada.
Tema: CLASE GRADO UNDÉCIMO 26 DE AGOSTO
Hora: 26 ago 2020 03:00 PM Bogotá
Unirse a la reunión Zoom
https://us04web.zoom.us/j/72778719776?pwd=Wm9EUlhhRS9GL3hWdFR5TkloT2lLdz09
ID de reunión: 727 7871 9776
Código de acceso: FkWub2
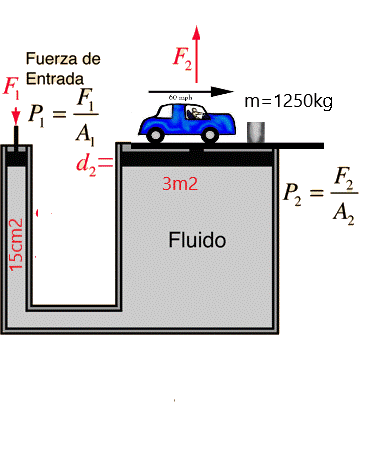
Para resolver algunos problemas se debe tener en cuenta que:
El área o superficie de un disco es pi por su radio al cuadrado.
ejemplo:
A1 = π R² = π 0,52 = 0,785 m² ;
A2 = π R² = π 2² = 12,566 m² ;
Recuerda que siempre hay que poner las dos áreas en la misma unidad dentro de la fórmula, mm2, cm2, m2, etc.
La masa se convierte a Newton multiplicando por la fuerza de gravedad (9.8m/s²)
Ejemplo 2:
¿Qué fuerza habrá que realizar en el émbolo pequeño de un elevador hidráulico para levantar un camión de 15000 kg? Los radios de los émbolos son 2 m y 10 cm.?
Datos:
A2= A1 = π R² = π (2m)2 = 12.57 m2.
A1 = π R² = π (0.1m)² = 0.031 m2