El link de la clase en línea para explicar las dudas acerca de esta temática es:
Carol Ramírez le está invitando a una reunión de Zoom programada.
Tema: CLASE GRADO DÉCIMO 28 DE JULIO
Hora: 28 jul 2020 02:30 PM Bogotá
Unirse a la reunión Zoom
https://us04web.zoom.us/j/71246021270?pwd=Q3pucWJuZ0NjcisxUXY0dVdSMUdjdz09
ID de reunión: 712 4602 1270
Código de acceso: 5t0RA8
FUNCIÓN ÁCIDO
Según Arrhenius, se consideran ácidos a aquellas sustancias que, al disolverse en agua, producen iones positivos de hidrógeno H+.
Existen dos tipos de ácidos: los ácidos hidrácidos y los ácidos oxácidos.
ÁCIDOS HIDRÁCIDOS
Son combinaciones binarias del hidrógeno con los halógenos (grupo VIIA) y del hidrógeno con el azufre. También se forma este tipo de ácido cuando se combina el hidrógeno con el grupo CN- (ión cianuro).
Estos compuestos se nombran anteponiendo la palabra ácido; luego el nombre especifico del no metal cambiando la terminación respectiva por el sufijo hídrico.
Ejemplo:
HCl : ácido clorhídrico
HCN: ácido cianhídrico
HF: ácido fluorhídrico
ÁCIDOS OXÁCIDOS
Estos ácidos son compuestos formados a partir de los óxidos ácidos de los no metales, cuando se combinan con el agua.
Ejemplo:
NOMENCLATURA PARA ÁCIDOS OXÁCIDOS:
Para escribir y nombrar ácidos oxácidos es importante saber las formulas y nombres de los iones negativos.
según la nomenclatura tradicional, se comienza con la palabra ácido y hace uso de los sufijos ico y oso, de los prefijos hipo y per, si existe mas de dos ácidos oxácidos de este elemento (esto depende de su estados de oxidación).
 En la nomenclatura stock, se inicia con la palabra ácido, el prefijo respectivo según la cantidad de oxígenos, seguido de la palabra oxo y la raíz del nombre correspondiente del elemento no metálico diferente del hidrógeno y del oxigeno, con la terminación ico y su numero de oxidación en números romanos.
En la nomenclatura stock, se inicia con la palabra ácido, el prefijo respectivo según la cantidad de oxígenos, seguido de la palabra oxo y la raíz del nombre correspondiente del elemento no metálico diferente del hidrógeno y del oxigeno, con la terminación ico y su numero de oxidación en números romanos.en la nomenclatura sistemática, se da el nombre del ion; luego, la expresión de hidrógeno.
ejemplo:
ACTIVIDAD 1
Utilizando los tres sistemas de nomenclatura vistos, nombre los siguientes ácidos oxácidos:
HClO
HClO2
HClO3
HClO4
H4SiO4
FUNCIÓN SAL
FORMACION DE SALES.
Las sales son cristales y solubles en agua, por lo general. Son sustancias binarias, ternarias y cuaternarias. Existen 2 tipos principales de ellas:
- a. Sales haloideas.
- b. Sales oxisales. Estas se clasifican en 4 tipos: sales neutras, ácidas, básicas y sales dobles.
Las diferentes sales resultan de la reacción entre un ácido y una base, siendo esta reacción de neutralización completa o bien parcial, y en todos los casos se produce también agua.
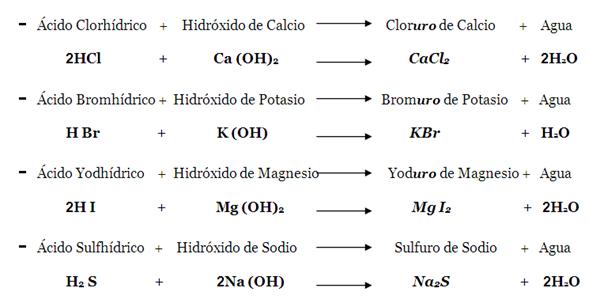
Sales haloides. Llamadas también sales haloideas y no-oxigenadas. Este tipo de sustancias se forman por una reacción de neutralización entre un hidrácido y un hidróxido o base, sobrando agua. Son compuestos binarios pues la sal contiene un metal y un no-metal halógeno .
1 .HCl + NaOH → NaCl + H2 O3
Neutralización entre Ácido Clorhídrico (Ácido) e Hidróxido de Sodio (Base),
para producir la sal Cloruro de Sodio más Agua.
1 .HCl + NaOH → NaCl + H2 O3
Neutralización entre Ácido Clorhídrico (Ácido) e Hidróxido de Sodio (Base),
para producir la sal Cloruro de Sodio más Agua.
2 Zn + 2HCl → ZnCl2+H2
Reacción de Zinc elemental con Ácido Clorhídrico, para producir la sal Cloruro de Zinc, más Hidrógeno en su forma gaseosa.
Para nombrar la sal haloidea se pone primero el nombre del no-metal, con terminación uro, y se le agrega el nombre del elemento metal. En este caso la sal recibe el nombre(nomenclatura)
de fluoruro de litio. Los dos hidrógenos del agua provienen uno del hidrácido y el otro del hidróxido, y el oxígeno proviene del hidróxido; por lo tanto, solo sobran el flúor (F) y el litio (Li), los cuales se unen y forman la sal haloidea (LiF). Otros ejemplos balanceados son:
1.Nomenclatura de las Sales Binarias:
- Nomenclatura Tradicional: no metal + sufijo "-uro" + metal + sufijo de valencia del metal (oso para la menor e ico para la mayor)
- NaCl: Cloruro sódico (solo posee 1 valencia → "-ico")
- FeCl2: Cloruro ferroso
- FeCl3: Cloruro férrico
- PbS: Sulfuro plumboso
- PbS2: Sulfuro plúmbico
- CoS: Sulfuro cobaltoso
- Co2S3: Sulfuro cobáltico
ACTIVIDAD 2 :
EJERCICIOS
| |
| Formular los siguientes compuestos: | Nombrar los siguientes compuestos: |
| a) Dicloruro de zinc | a) NaBr |
| b) Seleniuro sódico | b) BaF2 |
| c) Sulfuro ferroso | c) NiCl2 |
| d) Ioduro de calcio | d) CuCl2 |
| e) Difluoruro de magnesio | e) SrS |
- ESCRIBA LAS FORMULAS MOLECULARES
Cloruro de cobre(II)
Bromuro de sodio
Fluoruro de calcio
Cloruro de plomo(II)
Yoduro de platino(IV)
Sulfuro de hierro(III)
Telururo de níquel(III)
Seleniuro de berilio
Bromuro de mercurio(II)
Sulfuro de amonio
Seleniuro de plomo(IV)
QUÍMICA Y AMBIENTE 1 MCGRAW HILL [2/EDICIÓN] DE CÁRDENAS/GELVEZ
algunos apartes tomados de: http://laquimica2018inorganica.blogspot.com/2018/04/funcion-sales.html






No hay comentarios.:
Publicar un comentario